2025년 1월 14일, 중국 국가 시장감독관리총국은 <특수의료용도 전영양조제식품 등록지침>(이하 지침)을 발표하였다.
동 지침은 <특수의료용도 조제식품 등록관리방법> 수정 버전을 실시하고, 특수의료용도 조제식품 등록관리를 완비화하기 위함이며, 과학적 인식과 등록실천, 제품 연구개발과 생산 실제상황 등에 근거하여, 6개 측면으로 업데이트를 실시하였다.
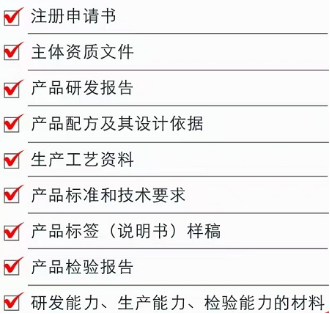
1. 등록신청시 제출 서류
①등록신청서, ②기업자질 증명서류, ③제품연구개발 보고서, ④제품 처방 및 그 설계 근거, ⑤생산공예 관련 자료, ⑥제품표준과 기술요구, ⑦제품라벨(설명서) 견본, ⑧제품 시험검사성적서, ⑨연구능력, 생산능력, 시험검사 능력 관련 서류. ⑩기타 제품의 안전성, 영양충족성 및 특수의료용도 임상효과 관련 서류
2. 제품 처방과 그 설계 근거
1) 열량, 비타민, 미네날, 선택 가능한 성분 등은 GB 29922의 규정에 적합해야 한다.
2) 제품 처방의 3대 영양소의 열량제공 비율은 <중화인민공화국 선식영양소 참고섭취량>의 권장범위에 적합해야 하며, 에네르기 밀도는 GB 29922의 규정에 적합해야 하고, 일반적으로 1.2kcal/mL를 초과해서는 안된다.
탄수화물은 유당, 말토덱스트린, 고체 옥수수시럽을 기원 원료로 해야하며, 단백질은 유단백과 대두단백을 원료로 해야한다. 지방은 일반적으로 대두유, 해바리기씨유, 옥수수유, 채종유, 야자유를 기원 원료로 해야 한다.
3) 영양강화제는 GB 14880의 규정에 적합해야 한다.
4) 식품 첨가물은 1~10세 인구군용 제품은 GB 2760 중의 영유아조제식품에 사용을 허용한 식품첨가물을 사용해야하며 사용량을 준수해야 한다. 10세이상 인구군용 제품은 GB 2760의 동일 제품 혹은 유사제품에 사용을 허용한 식품첨가물을 사용하고 사용량을 준수해야 한다.
3. 생산공예 관련 자료
동일 생산라인에서 기 등록된 전영양 특수의료용도 식품을 생산하고 있고, 등록하고자 하는 제품의 생산공예 및 파라메타, 형태 선택, 공예 등이 기 등록된 제품과 기본상 일치할 경우, 일치성 설명만 제출하면 된다. 생산공예 설계 근거, 문헌서류 등의 제출을 면제한다.
4. 안정성연구 관련
전영양조제식품 등록신청시, 안정성 연구를 시작한 시간과 관련 상황설명만 제품하면 되며, 연구보고서를 제출하지 않아도 된다. 단 신청인은 <특수의료용도조제식품 안전성연구요구(시행) (2017년 수정버전)>에 근거하여 안전성연구를 진행하고 관련 기록을 보존하여 조사에 대비해야 한다.
5. 연구능력과 생산능력 관련 서류
동일 생산라인에서 기 등록된 특수의료용도식품을 생산하고 있을 경우, 연구개발기관, 생산장소의 주요 시설설비, 생산능력 관리 체계 등 상황 일치성 설명만 제출하면 되며, 연구능력과 생산능력 관련 원시 서류와 관련 자료를 제출하지 않아도 된다.
6. 제품 라벨、 설명서 견본 관련 요구
제품 명칭、처방 특징/영양학적 특징、 식용방법과 식용량 관련 규정을 명확히하고 , 기타 표시사항은 <특수의료용도 조제식품 라벨、 설명서 견본요구(시행)>,<특수의료용도 조제식품 표시지침>의 관련 규정에 따라 규범적으로 표시해야 한다。
7. 현장실사
아래의 상황 외、 일반적으로 생산현장실사와 발췌검사를 진행하지 않는다。
1) 신청인이 처음으로 전영양조제식품 등록을 신청할 경우
2) 생산라인이 처음으로 등록을 신청하고자 하는 전영양식품 생산에 사용될 경우。
3) 기 등록된 제품과 비교시 생산공예에 큰 변화가 발생하였을 경우
4) 기타 생산현장실사와 발췌검사가 필요한 상황、 예 진실상황 은폐、 허위자류 제출, 관련 제보 및 감독관리부문이 실사가 필요하다고 인정하는 상황。 또 기술심사과정에서 현장확인이 필요하다고 인정하는 상황。






